Toekomst gezondheidszorg. Wat is de toekomst van de zorg? Wat is toekomstbestendige zorg? Vernieuwing in zorg en welzijn in Nederland, incl. voorbeelden!
Toekomst gezondheidszorg?
Wat is de toekomst van de zorg? Maken we veel meer gebruik van kunstmatige intelligentie systemen en operatierobots? Gaan patiënten steeds meer dingen zelf doen, van het meten tot diagnosticeren tot ingrijpen? Welke wetenschappelijke doorbraken zijn er in de biomedische en biotechnologie?
Wil je me inhuren voor een lezing of workshop over dit onderwerp? Bekijk deze pagina Trendwatcher Gezondheidszorg of doe direct een vrijblijvende boekingsaanvraag!
In dit verzamelartikel komen deze vragen aan bod, samen met een schets van de mogelijke invloed van de toekomstige zorg op medici, wetenschappers, verplegers, verzorgers, patiënten en cliënten.
Andere relevante artikelen over dit onderwerp zijn: Wat zijn tips voor zorginnovatie? / Zorginnovatie is meer dan technologie / Wat zijn voorbeelden van zorgtechnologie? / Alles over ChatGPT in de Gezondheidszorg / Alles over kunstmatige intelligentie in de zorg / 6 boeiende trends door een futurist gezondheidszorg.
Toekomst zorg & technologie
Wat is de rol van technologische ontwikkelingen als het gaat om de toekomst van de gezondheidszorg? Ik gaf een gastcollege bij de opleiding Gezondheidswetenschappen van de Erasmus Universiteit in Rotterdam. Daarin vertel ik over drie grote ontwikkelingen in de zorg: data, DIY biomedische technologie en genetische modificatie.
Bekijk de video:
Visies toekomst zorg
De opbouw van dit artikel is iets anders dan je gewend bent op de blog. In het eerste halfjaar van 2020 volg ik de cursus Wetenschapsjournalistiek van Stichting SCW. Het leek me leuk om het huiswerk voor deze cursus op te hangen aan de toekomst van de zorg.
Elk artikel belicht een ander thema en/of visie. Je kan hieronder direct doorklikken naar het thema waarin jij geïnteresseerd bent. De volgorde is chronologisch, dus de eerste opdracht staat bovenaan. Daarnaast verschilt het genre van de stukken; het is een mix van achtergrondartikelen, nieuwsberichten en interviews.
- Slimme salamanderaders voor de bypass – achtergrondartikel over regeneratieve geneeskunde;
- Nieuwe stap in maken embryo’s uit stamcellen – kort nieuwsbericht over knutselembryo’s;
- ‘Veel mensen vragen zich af of ze dat wel hadden willen weten’ – interview met klinisch geneticus Philip Jansen;
- De mythe het Alzheimer-gen ontkracht – achtergrondartikel over onderzoek naar de ziekte van Alzheimer;
- Mensen maken op een plaat – luchtig artikel over organ-on-a-chip technologie;
- Obesitas in de 18e eeuw – achtergrondartikel over geschiedenis van preventieve gezondheidszorg;
- Nanosensoren en kunstmatige cellen: een vooruitblik op de zorg in 2100 – vrije opdracht over de gezondheidszorg in 2100;
- Keanu redt ons niet – korte column over de rol van sciencefiction.
Een aantal artikelen publiceerde ik op een andere plek:
- De nucleaire kans van de coronapandemie – opiniestuk over internationale samenwerking rondom biotechnologie;
- Na de ruimte gaat Musk nu de hersenen in – achtergrondartikel over de plannen van het bedrijf Neuralink.
Veel leesplezier!

Slimme salamanderaders voor de bypass
Met afbreekbare kunststof en menselijke cellen kun je in het laboratorium een nieuw bloedvat kweken. Dat biedt hoop voor hartpatiënten.
‘Of ik de 190 nog wel eens aantik?’ Wouter Jansen Klomp lacht. Vijftien jaar geleden tijdens zijn studie geneeskunde in Groningen roeide hij in een acht op nationaal niveau. Nu houdt hij zich als cardioloog in het Deventer ziekenhuis niet bezig met de maximale hartslag bij inspanning. In de kliniek ziet hij vooral patiënten met een aandoening aan hart en vaten, zoals trombose of na een hartinfarct.
Welke doorbraken zien we in de genezing van vaatziekten in de komende jaren? Zijn er bijvoorbeeld al patiënten in Nederland met synthetische bloedvaten?
Cadeautje van de natuur
De huidige methode om een bypass aan te leggen werkt goed, maar kent ook nadelen. Jansen Klomp: ‘Het liefst gebruiken we medicatie en eventueel een dotterbehandeling om bloedvaten rondom het hart te verruimen.’ Op die manier stroomt het bloed weer goed door, maar in sommige gevallen is een bypass nodig.
Bij een bypass wordt een omleiding gemaakt langs een vernauwd bloedvat. Dit is een ingrijpende operatie waarbij de chirurg het borstbeen van de patiënt open zaagt, een openhartoperatie. Chirurgen kunnen twee wegen inslaan, die van de artera subclavia en bloedvaten uit het eigen lichaam.
Dit is een cadeautje van de natuur.
Wouter Jansen-Klomp, cardioloog
Het eerste type vat is makkelijk. ‘De arteria subclavia loopt onder het sleutelbeen naar de armen. Dit is een cadeautje van de natuur. Dit vat kunnen we goed gebruiken en eigenlijk heeft het zelden aderverkalking.’ Het tweede type bloedvat is een ader uit het been of de arm. ‘Zo’n ader wordt er dan helemaal uitgehaald. Dat is inclusief de zijtakjes die we dan dicht moeten maken.’
Toch zitten er twee nadelen aan deze bloedvaten uit het eigen lichaam. Het eerste is dat de vervangende bloedvaten sneller dicht gaan zitten. Een tweede nadeel is dat als een zijtakje niet goed afgesloten is, dat kan lekken. Zo ontstaan inwendige bloedingen.
Synthetisch vat
Slimme biomaterialen zijn wellicht de oplossing. In 2019 publiceerden wetenschappers van het Duke University Medical Center en het bedrijf Humacyte (Verenigde Staten) een studie waarin bij een patiënt met een nieraandoening een synthetisch bloedvat is ingebracht.
In Nederland doet het Dankerslab, aan de TU Eindhoven, onderzoek naar het gebruik van slimme biomaterialen in de regeneratieve geneeskunde. Promovendus Dan Jing Wu doet hier onderzoek naar. ‘Als we een vraag van artsen krijgen, dan kijken we wat het probleem op moleculair, het allerkleinste, niveau is. Op basis daarvan bouwen we slimme biomaterialen die met ons lichaam kunnen communiceren.’
Salamander effect
Wat zijn voordelen van slimme biomaterialen? De onderzoekers bouwen moleculaire eigenschappen in het materiaal, waarmee het opdrachten kan meegeven aan omliggende cellen. Zo kan het materiaal bijvoorbeeld cellen aansporen om bepaalde eiwitten af te geven of kan het zichzelf geleidelijk oplossen.
Dat is het belangrijkste verschil met implantaten, zoals de kunststofbuizen die nu worden gebruikt om een deel van de aorta te vervangen. Zo geeft onderzoeker Levitt van de Emory University School of Medicine (Verenigde Staten) aan dat plastic bloedvaten vatbaar zijn voor vernauwingen en verstoppingen.
Implantaten moet je op den duur vervangen. Wij kijken stiekem alweer een stapje verder.
Dan Jing Wu, onderzoeker Dankerslab Eindhoven
‘Implantaten moet je op den duur vervangen’ aldus Wu. ‘Wij kijken stiekem alweer een stapje verder.’ De materialen die zij in het Dankerslab gebruiken kunnen het lichaam helpen te herstellen en zijn biocompatibel. ‘Dit is net als het salamander-effect. Een staart van een salamander kan opnieuw aangroeien. Met slimme materialen kunnen we weefsels in het lichaam ondersteunen om zichzelf te repareren en over de tijd af te breken.’
Een andere term voor het werken met slimme programmeerbare biomaterialen is regeneratieve geneeskunde, waarbij het lichaam tijdelijk wordt ondersteund. Jansen Klomp ziet dit type synthetische bloedvaten wel zitten. ‘Conceptueel is het heel logisch. Dit heeft veel potentie.’
De petrischaal uit
Toch duurt het nog wel even voordat chirurgen in Nederland synthetische bloedvaten plaatsen bij patiënten die een bypassoperatie ondergaan. Volgens Jansen Klomp duurt het lang voordat een innovatief idee in de kliniek wordt toegepast. Niet zonder reden. ‘Voordat je een synthetisch vat bij patiënten inbrengt, wil je zeker weten dat het veilig is en dat het werkt. Niet alleen als cardioloog, maar ook als patiënt.’
Wu beaamt dit. ‘In het laboratorium proberen we alle situaties zoveel mogelijk te simuleren. Maar dan nog steeds zijn er zoveel factoren in het menselijk lichaam die invloed kunnen hebben op de werking van het materiaal.’ Toch hebben de synthetische bloedvaten uit Eindhoven het petrischaaltje al verlaten. Samen met de faculteit Diergeneeskunde in Utrecht worden de eerste experimenten bij dieren gedaan.
Als de potentie die Wu en haar collega’s zien wordt waargemaakt, dan is de vraag waar deze ontwikkeling stopt. Misschien kan Jansen Klomp dan met geüpgradede synthetische bloedvaten makkelijk weer 190 hartslagen per minuut halen in de roeiboot.
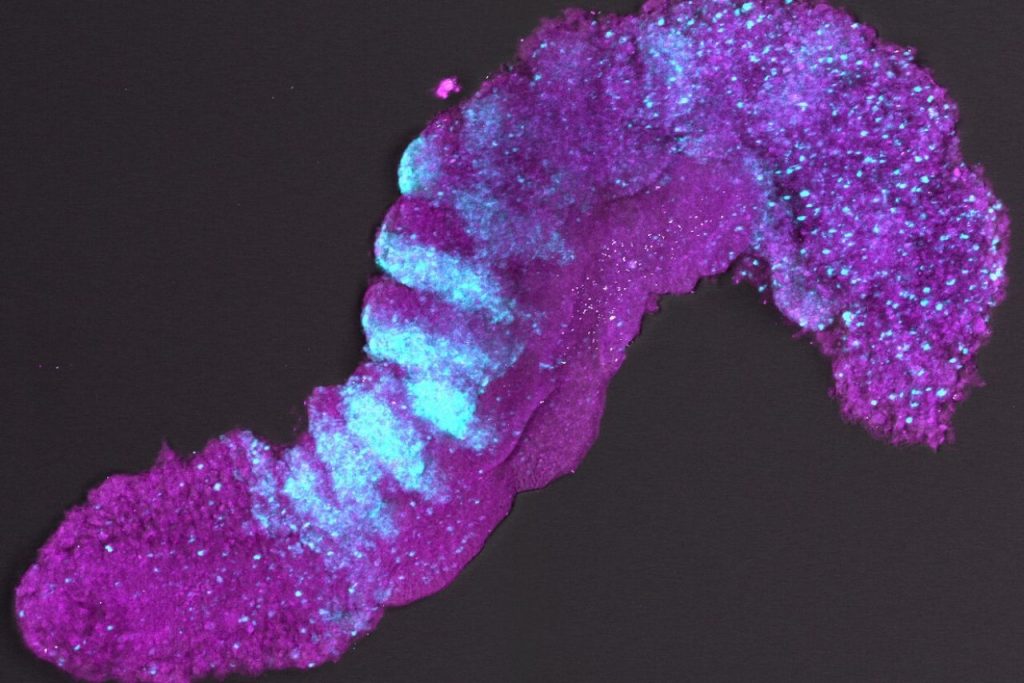
Nieuwe stap in maken embryo’s uit stamcellen
Wetenschappers van het Hubrecht Instituut in Utrecht en de Universiteit van Cambridge (Engeland) hebben met stamcellen een nieuw model ontwikkeld van een embryo van een muis. Hiervoor gebruikten ze stamcellen van de muis. Het uiteindelijk doel van de onderzoekers is om meer te weten over de ontwikkeling van menselijke embryo’s.
De embryo-achtige structuur heet in vaktermen een gastruloïde. In 2014 kweekten onderzoekers voor het eerst een gastruloide uit de stamcellen van een muis. Een stamcel is een type cel die in staat is om in een ander celtype te veranderen.
Nu is het de onderzoekers gelukt om een gastruloïde te maken die qua ontwikkeling lijkt op een gewone embryo net na plaatsing in de baarmoeder. Het belangrijkste verschil is dat een gastruloïde geen hersenen of placenta bevat. Daarmee is is de gastruloïde niet levensvatbaar; het kan niet uitgroeien tot een levend muisje en voelt geen pijn.
We zagen allerlei weefsels en celtypen, zoals de voorlopers van de keelholte, rug, bloedvaten en zenuwcellen.
Susanne van den Brink, onderzoeker
De onderzoekers publiceerden hun bevindingen deze maand in een paper in Nature. Ze claimen dat voor de eerste keer is aangetoond dat somieten groeien in een gastruloide. Somieten zijn klompjes cellen en vormen de basis van wervels en spieren die zich later in de embryo vormen. Hoofdonderzoeker Susanne van den Brink van het Hubrecht Instituut: ‘In de gastruloide zagen we allerlei weefsels en celtypen, zoals de voorlopers van de keelholte, de rug, bloedvaten en zenuwcellen.’
Onderzoeker Alexander van Oudenaarden van het Hubrecht Instituut in het persbericht: ‘Een groot voordeel is dat we de gastruloïden in grote hoeveelheden kunnen kweken. Daarmee kunnen we medicatie testen die helpen tegen defecten in de groei van embryo’s’.
- NB. Dit is hoe gastdocent Maarten Keulemans hier over schreef in de Volkskrant. Wat ik leuk vind, en dit was ook de belangrijkste tip van hem tijdens de les, is dat hij het beeldend uitlegt met termen zoals ‘hersenloze muis’, een ‘knutselembryo’ en ‘kneedembryo’.

‘Veel mensen vragen zich af of ze dat wel hadden willen weten’
‘Er is niet één gen voor intelligentie of één gen voor Alzheimer. Het zijn meestal heel veel genen die allemaal individueel een klein effect hebben.’
Philip Jansen is onderzoeker bij het Center for Neurogenomics and Cognitive Research (CNCR) van de Vrije Universiteit Amsterdam en arts op de afdeling klinische genetica bij het Amsterdam UMC. Hij doet onderzoek naar de relatie tussen genetica en het functioneren van de hersenen. Hiervoor gebruikt hij de rekenkracht van een supercomputer om het genoom van duizenden mensen tegelijk te vergelijken; hoe ziet hun DNA eruit en hoe scoren ze op allerlei gedragsmaten of scores op cognitieve testen.
Wat is het doel van je onderzoek?
We proberen aan de hand van iemands DNA het risico op bepaalde ziektes te voorspellen, een zogenoemde polygenetische risicoscore. Deze score weerspiegelt het risico dat een patiënt heeft om een bepaalde aandoening te krijgen, zoals type 2 diabetes, hart- en vaatziekten of borstkanker. Artsen kunnen die score in de toekomst gebruiken om te bepalen welke patiënten een hoger risico hebben en bijvoorbeeld vaker op controle moeten komen.
Ik heb mijn DNA laten testen bij het Amerikaans bedrijf 23andme. Wat vind je daarvan?
‘Een deel van wat die bedrijven aanbieden is relatief onschuldig. Zo vertellen ze je waar je voorouders waarschijnlijk hebben geleefd. Maar ze zeggen ook iets over ziekterisico’s en dat is niet zo onschuldig. Enerzijds omdat die bedrijven doen vermoeden dat ze alles testen, maar dat is bij lange na niet zo. Ten tweede kunnen de resultaten tot zorgen leiden. Misschien kom je er wel achter dat je risico loopt op een bepaalde aandoening die niet behandeld kan worden. Had je dat dan wel willen weten? Veel mensen vragen zich daarom achteraf af of ze dat wel hadden willen weten.
Had je dat dan wel willen weten?
Philip Jansen, CNCR Amsterdam
Heb jij ook zo’n test gedaan?
Ja, al een hele tijd geleden. Er kwam niets schokkend uit, maar dat betekent dus niet dat ik geen kans heb op erfelijke aandoeningen.
Waarom ben je eigenlijk geneeskunde gaan doen?
Lachend: ‘Om het in het thema te houden: het zit in mijn genen, denk ik! Ik kom uit een familie met artsen, dus eigenlijk was er vroeger niet echt een keuze. De geneeskunde raakt aan heel veel dingen. Het gaat over het mens zijn en de psychologie, maar ook over ingewikkelde mechanismen op het allerkleinste niveau in de cellen.’
Waarom wilde je onderzoek doen naar de relatie tussen genetica en het brein?
Vroeger dacht ik dat het brein de bron is van al het menselijke gedrag. Maar toen kwam ik erachter dat het brein op zijn beurt weer wordt beïnvloed door DNA. Het DNA bevat de blauwdruk voor de constructie van het brein. Dat vind ik fascinerend. Want we weten eigenlijk nog zo weinig over de invloed van genetica op de hersenen en daarmee op gedrag, psychiatrische klachten en hersenaandoeningen.
Het DNA bevat de blauwdruk voor de constructie van het brein.
Philip Jansen, CNCR Amsterdam
Hoe ziet je onderzoek eruit?
Ongeveer 0,1% van het DNA verschilt tussen mensen. Dat is voor ons het interessantste gedeelte van het DNA. In totaal gaat het dan om miljoenen verschillen in genen, de bouwstenen van het DNA. In een grote dataset kijken we naar elk van die verschillen en vergelijken dat met de score van de proefpersonen op een cognitieve test. In vaktermen heet dit een GWAS, een genome wide association study.
Wat is de belangrijkste bevinding tot nu toe?
Vaak is niet één gen bepalend voor één eigenschap. Er is geen intelligentie-, depressie- of schizofrenie-gen. Voor elke eigenschap zijn er wel honderden of duizenden genen, die allemaal een klein beetje invloed hebben. Dat geldt trouwens niet voor alle aandoeningen, zoals de hersenziekte Huntington. Dan is één foutje in het gen wel bepalend’.
Ons doel is om de schakel beter te begrijpen, van gen naar gedrag.
Philip Jansen, CNCR Amsterdam
Maar met alleen zo’n data-analyse ben je er nog niet.
Ons onderzoek is de eerste stap in een lange schakel van ontdekkingen. Eerst kijken we naar welke variant van een gen betrokken is bij een eigenschap, zoals cognitief functioneren. Hierna kijken onze collega’s in het laboratorium in welk weefsel of welke celtype dat gen tot uiting komt. Daarna kunnen we uitdokteren hoe de expressie van het gen in het lichaam leidt tot een ziekte. Ons doel is om de schakel beter te begrijpen, van gen naar gedrag.
Wat voor impact heeft je werk op de kliniek?
De risicovoorspellingen waar wij aan werken op basis van vele genen tegelijk worden nog niet in de kliniek gebruikt. Maar als het zover is, moeten we goed nadenken over de implementatie. Wat willen mensen überhaupt weten? Hoe reageren ze erop als ze een hoog risico hebben? Wat vertellen we de patiënt, op welke manier en hoe bieden we ondersteuning? Aan veel aandoeningen kun je namelijk niets doen om ze te voorkomen. Dat is het grote verschil met andere type testen, van bijvoorbeeld bepaalde bloedwaarden. Je DNA blijft gelijk, dat kun je niet veranderen.

De mythe het Alzheimer-gen ontkracht
Alzheimer zit in mijn DNA. Wat kan ik doen? Helpt een gezonde leefstijl? Of kan ik wachten op doorbraken zoals genetische modificatie van mijn hersencellen?
Mijn oma Lena had geen idee. Geen benul waar ze was, wat ze daar deed of hoe ze daar was gekomen. Ze liep een paar straten van haar huis verdwaasd rond tot een buurtgenoot haar zag en wist dat er iets niet klopte. Hij bracht haar naar huis. ‘Nu is het genoeg’ zei mijn opa. Hij had het al langer door, maar wilde het niet toegeven. Ze ging naar een speciaal verpleeghuis voor patiënten met dementie en leefde daar nog twintig maanden voordat ze overleed op 77-jarige leeftijd.
Verwoestende ziekte
Ruim 280.000 Nederlanders hebben dementie. Hoe ouder je wordt, hoe groter de kans dat je het krijgt. Door de vergrijzing is de verwachting dat het aantal patiënten in de komende vijfentwintig jaar verdubbeld naar ruim 520.000. Dat concludeert onderzoeksinstituut Nivel in het rapport Een samenhangend beeld van dementie en dementiezorg . Daarbij zorgt de aandoening voor de meeste gezondheidsverlies per patiënt in Nederland, dit zijn de jaren geleefd met ziekte en de jaren verloren door vroegtijdige sterfte.
De ziekte leidt tot een groot verlies aan kwaliteit van leven. Niet alleen voor de patiënt, maar ook voor diens omgeving. Veel patiënten overlijden uiteindelijk aan de ziekte.
Zijn er manieren om dementie te voorkomen? Zeker wanneer het, zoals in mijn geval, in de familie voorkomt?
Dementie is niet altijd Alzheimer
De termen dementie en (de ziekte van) Alzheimer worden vaak door elkaar gebruikt. Dementie is een verzamelterm voor de achteruitgang in denkvermogen en verandering in gedrag. Alzheimer is de meest voorkomende vorm van dementie, tussen de 60 en 70% van de dementerenden heeft de ziekte van Alzheimer.
Een gangbare hypothese is dat een abnormale stapeling van eiwitten in de hersenen de ziekte van Alzheimer veroorzaakt. Dit leidt tot een achteruitgang van de hersencellen. De patiënt verliest zijn kortetermijngeheugen en krijgt vaak ook spraakproblemen. Ook zijn gedrag kan veranderen.
Voorspelling Alzheimer
Heb ik, als de kleinzoon van een Alzheimerpatiënt, meer kans om ook die aandoening te krijgen? In Nederland doet het Center for Neurogenomics and Cognitive Research (CNCR) onderzoek naar de relatie tussen genetica en het cognitief functioneren. CNCR onderzoeker Philip Jansen: ‘We proberen aan de hand van iemands DNA zijn risico op een bepaalde hersenziekte te bepalen.’
Volgens Jansen is er niet één gen voor Alzheimer: ‘Het zijn meestal heel veel genen die allemaal individueel een klein effect hebben.’
Niet deterministisch
Ondanks het voorbehoud dat er niet één Alzheimer-gen is, hebben veel medisch wetenschappers het APOE-gen in het vizier. Jansen: ‘Er zijn verschillende varianten van dit gen. In het meest ongunstige geval heb je twee nadelige mutaties. Met één nadelige mutatie heb je een licht verhoogd risico’. Volgens Jansen komt dit laatste in ongeveer 15% van de bevolking voor
Ook bij mij. In 2016 heb ik een DNA-test gedaan bij het Amerikaanse bedrijf 23andme. Daar stond in het rapport dat ik inderdaad een licht verhoogd risico heb om Alzheimer te krijgen. Overigens weet ik niet of ze bij deze kansberekening het APOE-gen hebben betrokken.
Je DNA zegt niet alles. Het is niet deterministisch
Philip Jansen, CNCR Amsterdam
Jansen stelt dat veel mensen met deze enkele variant geen Alzheimer krijgen. Bovendien zijn er veel Alzheimer-patiënten die deze variant niet dragen. Jansen waarschuwt me dan ook dat ik niet teveel waarde aan de test moet hangen: ‘Je DNA zegt niet alles. Het is niet deterministisch’.
Veroudering begint vroeg
Joukje Oosterman is het eens met de uitspraak van Jansen. Bij het Donders Instituut in Nijmegen, onderzoekt zij de relatie tussen leeftijd en cognitief functioneren. ‘Er zit zeker een familiaire component bij de kans op het krijgen van de ziekte van Alzheimer. Maar de variant op het APOE-gen is risicoverhogend, niet allesbepalend’.
Veroudering begint eigenlijk al eerder dan de meeste mensen denken
Joukje Oosterman, Donders Instituut
Dertig procent van de Alzheimergevallen kun je voorkomen met een gezonde leefstijl. Hier kun je niet vroeg genoeg mee beginnen.
Oosterman: ‘Veroudering begint eigenlijk al eerder dan de meeste mensen denken. Dat zien we aan bijvoorbeeld de stevigheid van cellen, maar ook in het geheugen en cognitieve taken zoals plannen en gedragsimpulsen onderdrukken. Dat is op een jongere leeftijd, zo rond je dertigste, al te zien in hersenscans.’
Jong starten
In haar onderzoek kijkt Oosterman vooral naar de rol van de zogenaamde cognitieve reserve. Dit is een term voor de mate waarin iemand het effect van breinschade op het geheugen en op het gedrag kan compenseren. Oosterman: ‘Het lijkt erop dat als je gezond leeft, volop cognitieve uitdagingen aangaat, zoals het leren van een instrument of taal, en veel sociale contacten hebt, je meer van deze reserve opbouwt. Zeker als je jong begint en het consciëntieus volhoudt.’
Oosterman staat niet alleen in het pleidooi voor een gezonde leefstijl om de kans op Alzheimer te verkleinen. In oktober 2019 schreven 67 zorgprofessionals en experts op het gebied van dementie een open brief aan de minister met een oproep om te investeren in preventie en leefstijl [link onderin]. Hieronder verstaan ze onder meer genoeg lichaamsbeweging, gezonde voeding en voldoende slaap.
CRISPR in mijn brein
Ik leef nu al best gezond, al zeg ik het zelf. Wat als ik toch Alzheimer krijg? Daarbij: het volhouden van een gezonde leefstijl is niet altijd even makkelijk.
Het zou makkelijk zijn als technologie dat kan oplossen. Neem het Zwitsers zakmes van de biotechnologie: CRISPR/cas9. Het lijkt alsof bijna alles kan met deze recent ontdekte methode van genetische modificatie. Kan ik straks de Alzheimer uit het DNA van mijn hersencellen knutselen?
Zowel Jansen als Oosterman zijn sceptisch. Volgens Jansen is het technisch een enorme uitdaging: ‘Om door de bloed-brein barrière te komen en alle 86 miljard cellen van de hersenen te bereiken met technieken als CRISPR-CAS is heel moeilijk, zo niet onmogelijk.’ Oosterman ziet er ook geen heil in. ‘Dat klinkt erg ver weg. Er spelen zoveel factoren een rol en dan lijkt leefstijlaanpassing me toch veel makkelijker. ’
Saai
Het is niet anders. Het genenpakket met daarin de handleiding voor het bouwen van mijn brein bevat een licht verhoogd risico op Alzheimer. Misschien lukt het wetenschappers ooit om dit uit het DNA van mijn neuronen te slopen. Maar daarop wachten durf ik niet aan. Ik probeer me te houden aan die gezonde leefstijl.
Tja, het is wel een stuk saaier dan het hacken van je DNA. Maar denkend aan het slotstuk van het leven mijn oma Lena wandel ik toch naar buiten; een appel kauwend en de tafel van zeven oefenend in mijn hoofd.

Mensen maken op een plaat
Organen kweken op een plaat, net zoals een bouwpakket. De volgende stap is een volledig mens. Met bloedvaten uit Twente.
Chips. Niet van die ribbelige, of met weinig vet, gekruld als tuitje zoals een Doritos, of gedraaid zoals een Wokkel. Wie heeft er eigenlijk bedacht dat zure-room lekker is als je het frituurt en zout op smijt?
Nee, die andere chips. Die eet je niet, behalve ijzervreters.
Overal hebben we die chips. In de telefoon (met of zonder Corona app), in de auto, laptop en volgens trendwatchers straks echt in alles; berekeningen doen, verbinden met het Internet, data doorgeven en ons overal volgen.
Organen bouwpakket
Maar nu dit: chips om organen na te bouwen. Geen volledige elektrische vervanging zoals een pacemaker en ook geen gestileerde klomp kweekweefsel. De organ-on-a-chip technologie is een bak met gaatjes, clustertjes en kanaaltjes. De organoplate is een bouwpakket om thuis je eigen orgaan te kweken. Leuke tip voor als je nichtje jarig is.
Die platen zijn de 21e eeuwse opvolgers van de ellendig ouderwetse petrischaaltjes. Gepionierd door microbioloog Donald Ingber en uitgebouwd door Mimitas. Dat Leidse bedrijf verkoopt de bouwpakketjes voor goed geld aan onderzoekers en farmaceuten. De kopers strooien cellen op platen, kweken organen, laten ziekten infiltreren en testen medicijnen.
Barbapapa
Stamcellen zijn manusjes-van-alles die in alle andere type cellen kunnen transformeren, net zoals Barbapapa. De stamcellen zijn de bouwblokjes van de chip-organen. Met een beetje liefde, aandacht en oh ja, de juiste voeding klitten de blokjes samen tot een nieuw orgaantje.
De organ-on-a-chip wereld is verdeeld in kleine koninkrijkjes. Jos Joore, het opperhoofd van Mimitas, ziet dat elk instituut zich specialiseert in een orgaan. In Twente zijn ze trouwens goed in bloedvaten.
Je zou een bouwpakket van alle organen kunnen maken en die aan elkaar leggen, net zoals een enorme legpuzzel van Jan van Haasteren. Dat idee had organ-on-a-chip pionier Inger ook. In januari 2020 presenteerde hij het lichaam-op-een-chip; acht platen met verschillende organen aan elkaar geknoopt met een bloedsomloop.
Die omloop kwam vast uit Twente.

Obesitas in de 18e eeuw
Obesitas wordt meestal aangeduid als een moderne welvaartsziekte. Wetenschappelijk onderzoek laat zien dat we al eerder te kampen hebben gehad met een obesitasepidemie. In de 18e eeuw steeg de welvaart in Nederland snel, waardoor mensen minder gingen bewegen en meer gingen eten. Historicus Rina Knoeff (Rijksuniversiteit Groningen) legt uit hoe medici hiermee omgingen en wat nog meer kunnen leren van de medische geschiedenis.
‘Teveel masturberen leidt tot een uitgeput lichaam, verzwakte organen en erge koortsen.’ Deze waarschuwing gaven de Leidse professor Jeroen Gaub (1705-1780) aan jonge mannen in de 18e eeuw. In tegenstelling tot het zaad van jonge mannen moesten urine en ontlasting het lichaam zo snel mogelijk het lichaam uit. Een slechte stoelgang zorgde volgens hem tot ophoping en verstopping van de darmen.
Omstandigheden van de patiënt
Rina Knoeff smult van dit soort voorbeelden. Als medisch historicus doet ze aan de Rijksuniversiteit Groningen onderzoek naar gezondheidszorg door de eeuwen heen.
Teveel masturberen leidt tot een uitgeput lichaam, verzwakte organen en erge koortsen
Professor Jeroen Gaub (1705-1780)
‘Tot in de 18e eeuw dachten medici niet na over ziekte en gezondheidheid in termen van bacteriën en virussen. Die kennis was er nog niet.’ Om die reden keken artsen naar omstandigheden van de patiënt, zoals het klimaat, eten, drinken, slapen en beweging. Die factoren konden ze beïnvloeden en waren daarmee hun belangrijkste hulpmiddelen.
Rond 1800 verschoof de nadruk in de geneeskunde van voorkomen naar genezen. De reden hiervan was de wetenschappelijke vooruitgang in die tijd. Medisch wetenschappers richtten zich meer op statistiek, kwantitatief onderzoek in laboratoria en instrumenten zoals thermometers.
Volgens Knoeff veranderde deze omslag ook de relatie tussen de dokter en de patiënt. ‘Vanaf die tijd is de ziekte belangrijker dan de patiënt. De mens was niet meer ziek, maar er was iets aan de hand met een orgaan.’ Dokters kregen een enorme autoriteit en de preventieve gezondheidszorg verdween naar de onderkant van de hiërarchische medische ladder.
Leven als een boer
Overgewicht en obesitas lijkt een probleem van deze tijd. Knoeff lacht als ze dat hoort. ‘Bijna alles is vroeger al eens gebeurd.’ Zo kampte Nederland in de 18e eeuw al met obesitas. Dit kwam door de toenemende welvaart, waardoor mensen steeds meer gingen eten en minder bewogen. ‘De medici in die tijd probeerden via persoonlijke experimentjes erachter te komen welke voedingsmiddelen gezond waren en welke niet. Zo kwamen ze met voorschriften voor een vegetarisch dieet met veel groente, fruit en noten.’
Rijke mensen weigerden om te leven als een boer
Rina Knoeff
Niet alle leefstijladviezen vielen even goed. De artsen in die tijd zagen dat arme boeren geen last hadden van overgewicht. De tip voor de obese stadsbewoners was daarom om meer te leven als een boer; eten van het land en de hele dag door bewegen. Knoeff: ‘Dit leidde tot veel consternatie en ophef in de vorm van satirische gedichten en spotprenten. Rijke mensen weigerden om te leven als een boer.’
Hemelbed met rozenblaadjes
Het recept om gezond oud te worden omvat meer dan alleen gezond eten en voldoende bewegen. Neem slaap. De Tacuinum sanitatis (vertaald als Almanak der Gezondheid) was een begrip in de 15e eeuw. De Almanak was een soort stripverhaal met tekeningen over hoe je gezond kan blijven. Goed slapen helpt daarbij. Als je dat niet doet volgens de Almanak, dan verliezen de zintuigen hun kracht en ging woede overheersen.
Volgens Knoeff waren er vroeger al veel gedetailleerde ideeën over hoe je beter kan slapen. ‘Dat ging over de plek van het bed in de kamer, of het raam open moest en of je kamerplanten bij je bed moest hebben’. Een suggestie voor de welgestelden is om rozenblaadjes op het doek van je hemelbed te strooien. Of zoals een afbeelding in de Tacuinum sanitatis suggereert: een violist in je slaapkamer om je slaap te brengen.
Als ze druk waren en veel zorgen hadden, dan sloten ze zich op in deze kamer om een luchtje te scheppen
Rina Knoeff
Of stress. Daar hadden welgestelden in de 18e eeuw ook al oplossingen voor. Knoeff: ‘In de 18e eeuw hadden rijken een kamer vol met landschapschilderijen. Als ze druk waren en veel zorgen hadden, dan sloten ze zich op in deze kamer om een luchtje te scheppen.’
Brief uit China
Haar wetenschappelijke loopbaan startte Knoeff met haar onderzoek naar de Boerhaave school. Knoeff: ‘Herman Boerhaave was een autoriteit in zijn tijd. Je zou kunnen zeggen dat het onze Isaac Newton was’. Boerhaave was in zijn tijd een wereldwijde beroemdheid. Zo werd er op een dag een brief uit China bij hem in Leiden bezorgd. Op de brief stond alleen: ‘Boerhaave. Europa’.
De reden van zijn populariteit en aanzien lag niet zozeer in zijn wetenschappelijke ontdekkingen. Knoeff: ‘Hij was een ontzettend goede onderwijzer. Zo kwam hij altijd opdraven als hij college moest geven. Dat klinkt nu heel normaal, maar dat was toen echt een unicum!’ Zijn lesmethode was radicaal anders dan die van zijn collega’s. Hij sprak begrijpelijk Latijn en stimuleerde zijn studenten om zelf na te denken en daarmee zichzelf te ontwikkelen. Volgens Knoeff was dat voor die tijd echt uitzonderlijk.
Gezondheid is relatief
Het belangrijkste inzicht uit de geschiedenis is de definitie van gezondheid. Knoeff: ‘Vroeger was gezondheid relatief. Wat gezond voor de één gezond is, hoeft niet gezond te zijn voor de ander’. Dit geldt volgens haar gelukkig ook voor steeds meer hedendaagse gezondheidsadviezen, deze zijn niet voor iedereen hetzelfde.
Zo gek waren de adviezen zoals die van professor Jeroen Gaub dus nog niet. Maar gelukkig weten we nu dat masturberen niet ongezond is.

Een vooruitblik op de zorg in 2100
In sciencefiction films zijn ziekenhuizen overbodig, opereren robots ons en varen nanosensoren door onze bloedbanen. Hoe ziet de zorg er aan het einde van deze eeuw uit?
Corona Zuidvliet meldt zich bij de receptionist van het UMC Amazon Holland in Randstad aan Zee, het voormalige Utrecht. Ze weet dat de receptionist een humanoid is, een robot met het uiterlijk van een mens. Dat ziet ze aan een oranje icoontje dat oplicht in haar gezichtsveld. Haar contactlens toont ondertussen ook de beurskoers en de feed van de gebeurtenissen in de virtuele Fortnite wereld. Corona twijfelt ondertussen welke wereld ze belangrijker vindt.
Corona komt voor een nieuwe nier. De nanorobots in haar bloedbaan hebben gedetecteerd dat haar orgaan aan vervanging toe is. Een volledig kunstmatige variant staat al klaar, gepersonaliseerd en geoptimaliseerd.
Corona kijkt schrikt op uit haar gedachten. De humanoid glimlacht. ‘Corona. Wat een bijzondere naam. Je bent te jong om het Mexicaanse biertje te kennen. Ben je verwekt tijdens de lockdown van de pandemie in 2020?’
Terugblik op 2020
Er zullen vast kinderen geboren worden met de voornaam Corona. Maar voor de rest is de toekomstschets fictief. Of niet? De pandemie waar Corona naar is vernoemd, heeft wereldwijd in ieder geval een ontwrichtende werking op zorgsystemen en economieën. Tom van de Belt ziet ook andere effecten. Hij is assistent-professor digital health bij REshape, de innovatieafdeling van het Radboudumc in Nijmegen. Volgens hem is de belangrijkste kracht bij zorginnovatie dat je inspeelt op acute problemen binnen het zorgsysteem.
Van de Belt: ‘Neem bijvoorbeeld de coronapandemie, die zette een aantal dingen in de versnelling. Opeens was meer mogelijk en zochten mensen in de zorg creatieve oplossingen’. Zo zag het Radboudumc een immense dreiging: een tekort van beschermingsmateriaal waaronder mondkapjes en gezichtsbeschermers. Binnen vijf weken had het ziekenhuis met haar partners waaronder het bedrijfsleven een masker ontworpen, getest en in productie gekregen. Van de Belt: ‘Dit is bizar snel. met mijn jarenlange ervaring met innovatie in de zorg sta ik hier nog steeds met mijn oren van te klapperen’.
Zelfmanagement
Een ander voorbeeld is een boost in zelfmanagement. Door goedkopere sensortechnologie in de vorm van wearable devices kunnen patiënten steeds meer metingen zelf – in de thuissituatie – verrichten. Omdat veel patiënten in Nederland in verband met Coronamaatregelen niet naar het ziekenhuis mogen komen, worden ze nu vaker aangemoedigd thuis metingen te doen met een bloeddrukmeter of wearable device.
Ook communiceren ze vaker via beeldbellen met zorgverleners. Deze laatste lijkt een blijvertje. De kwaliteit van die zorg op afstand hoeft niet onder te doen voor zorg waarbij in het monitoren in het ziekenhuis plaatsvindt blijkt uit recent wetenschappelijk onderzoek [link onderin].
Friszure herinnering
De schets uit 2100 blijft daarmee wat het is: een fictie, gebaseerd op lijnen en ontwikkelingen die nu zichtbaar zijn. Maar wat corona (de pandemie, niet het personage uit de inleiding) vooral laat zien, is dat de toekomst geen lineaire extrapolaties zijn uit het verleden. In 2020 moeten we het nog steeds doen met de entree van Amazon op de Nederlandse markt als online retailer, Fortnite als immens populaire game en Corona als herinnering aan een friszuur biertje.
Met citroen.

Keanu redt ons niet (column)
Een anarchistische wereld is verwoest door de klimaatcrisis. Criminelen dragen illegale implanteerbare messen om elkaar te vermoorden. Met een bijrol voor een gedigitaliseerde Keanu Reeves, bekend als acteur van onder andere de film The Matrix.
Cyberpunk 2077 komt komende september uit. De trailer van deze game verscheen afgelopen week op Youtube en voldoet aan al mijn verwachtingen.
Dit droevige beeld van de toekomst zie je overal in sciencefiction. Als ik naar de serie Black Mirror op Netflix kijk, dan word ik daar naar van. Robotbijen die mensen vermoorden, mensen die voor altijd gevangen zitten in virtual reality of mechanische honden die heersen over de wereld. In Black Mirror, maar ook andere series en films over de toekomst zijn bijna altijd deprimerend en naargeestig.
In al die werelden heerst onderdrukking, dood en verderf. Vaak met behulp van wetenschappelijke en technologische vooruitgang. Denk aan hersenimplantaten om mensen te beheersen (zoals in het boek Neuromancer), losgeslagen cyborgs (zoals in de film Ghost in the Shell) of onderdrukking door kunstmatige intelligentie (zoals in The Matrix).
Dat is een probleem.
Wijzelf, onze kinderen en kleinkinderen worden gevormd door de populaire cultuur. Als die cultuur ons inboezemt dat de wereld over een aantal decennia toch naar de knoppen is, waarom zouden we nu onze best moeten doen? Als die cultuur ons leert dat wetenschap door boeven, schurken en dictators wordt gebruikt, waarom zou je willen meewerken aan ontwikkeling en vooruitgang?
Als we écht willen, kan onze toekomstige wereld mooier zijn dan die nu is. Juist door het vergroten van kennis in de wetenschap en technologie. Verhalen zijn daarbij even belangrijk als wetenschappelijke vooruitgang. Sciencefiction schrijvers, pak je kans! Ga ons inspireren, niet deprimeren.
Want Keanu gaat ons deze keer echt niet redden.

Leeslijst
In de media
In de podcast Listening to the Future werd ik in april 2020 geïnterviewd over de toekomst van de gezondheidszorg.
In 2019 werkte ik mee aan een productie van Achmea over de toekomst van de gezondheidszorg:
Dit zijn artikelen in tijdschriften en kranten:
- Interview: FOKUS Healthcare (2021)
- Column: Een narcistische dataseksueel (De Eerstelijns, 2019)
- Artikel: Zorginnovaties gaan soms sneller dan mensen aankunnen (Volkskrant, 2018)
Links
Dit zijn de links uit het stuk ‘Nieuwe stap in maken embryo’s uit stamcellen’
- Publicatie in Nature
- Artikel in Volkskrant
Dit zijn de links uit het stuk ‘Veel mensen vragen zich af of ze dat wel hadden willen weten’
Dit zijn de links uit het stuk ‘De mythe het Alzheimer-gen ontkracht’
- Website Joukje Oosterman
- Rapport NIVEL over dementie
- Open brief over preventie bij dementie
Dit zijn de links uit het stuk ‘Mensen maken op een plaat’
- Artikel Financieel Dagblad over organ-on-a-chip
- Website Mimitas
- Necrologie Menno Steketee
Dit zijn de links uit het stuk ‘Obesitas in de 18e eeuw’
- Profiel Rina Knoeff
Dit zijn de links uit het stuk Nanosensoren en kunstmatige cellen: een vooruitblik op de zorg in 2100
PS. Wil je me inhuren voor een lezing of workshop over dit onderwerp? Bekijk deze pagina Trendwatcher Gezondheidszorg of doe direct een vrijblijvende boekingsaanvraag!
Wat opdrachtgevers zeggen over Peter
Zijn verhaal gaf duidelijke inzichten en raakvlakken voor alle betrokken afdelingen. Leuke interactie met het publiek!
Voor herhaling vatbaar!

Maarten Cornelissen, Martiniziekenhuis Groningen
Wat een energie bracht Peter met zich mee!
Veel leuke, enthousiasmerende voorbeelden, humor en interactie met het publiek kenmerkte de lezing van Peter.

Kiki Vergoossen, Diakonessenhuis
Interesse?
In mijn lezingen, workshops en webinars geef ik een overzicht van de meest relevante (technologische) ontwikkelingen, de kansen die ze opleveren en de risico’s die ze met zich mee brengen.
Mijn insteek is praktisch, met talrijke concrete voorbeelden, humor en veel interactie met de deelnemers.
Interesse?
In mijn lezingen, workshops en webinars geef ik een overzicht van de meest relevante (technologische) ontwikkelingen, de kansen die ze opleveren en de risico’s die ze met zich mee brengen.
Mijn insteek is praktisch, met talrijke concrete voorbeelden, humor en veel interactie met de deelnemers.







